红光(波长600–700 nm)是光合作用与设施农业补光的主要波段,其利用效率直接关联作物产量。在叶绿体中,光系统 Ⅰ(photosystem Ⅰ,PSⅠ)与光系统 Ⅱ(photosystem Ⅱ,PSⅡ)通过协同吸收光能驱动光合电子传递;然而,红光对PSⅡ的优先激发特性,易导致光合电子传递链关键载体—质体醌(plastoquinone,PQ)库发生过度还原,破坏光合电子传递平衡,最终引发PSⅡ光化学效率下降。因此,阐明叶绿体如何感知并响应红光以维持高效光合作用是亟待解决的关键科学问题。质体小球是附着于类囊体膜的脂蛋白颗粒,兼具叶绿体“代谢枢纽”与PQ“储备库”的双重功能:在光胁迫条件下,其可通过精准调控PQ的合成、储存与动态分配,向类囊体补充PQ以维持PQ库稳态,并增强对单线态氧(¹O₂,光胁迫下叶绿体产生的有害物质,可损伤PSII)的清除能力,保障光合作用高效运行。但质体小球如何感知红光信号,进而启动PQ补充机制仍不清楚。
2025年10月4日,北京大学现代农业研究院/潍坊现代农业山东省实验室邓兴旺院士团队在国际知名期刊《Molecular Plant》在线发表题为“Redox-regulated plastoglobule ABC1K1–ABC1K3 kinase complex controls plastoquinone mobilization for chloroplast photosynthetic adaptation to red light”的研究论文。该研究首次解析了红光下叶绿体通过质体小球ABC1K1–ABC1K3激酶复合体的氧化还原动态调控,维持PQ库稳态并保护PSII功能的分子机制,为理解植物光合适应的精细调控网络及作物光合效率改良提供了新视角。
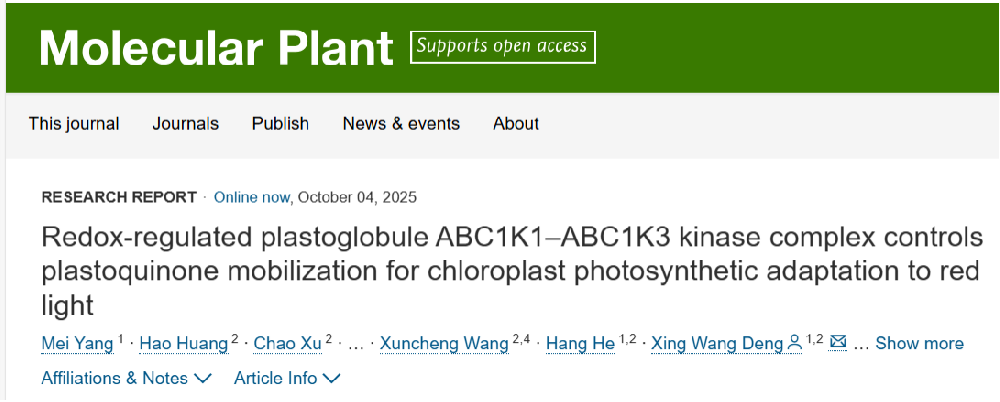
ABC1K(ACTIVITY OF BC1 COMPLEX KINASE)激酶家族是质体小球核心蛋白中占比第二的家族(约19%)。其成员ABC1K1与ABC1K3为质体小球的核心调控激酶,二者通过蛋白互作形成功能复合体,在PQ动态分配中发挥决定性作用:abc1k1突变体因无法将质体小球储存的PQ运输到类囊体膜PQ库中,导致PSII效率降低、D1蛋白降解和叶绿体受损;而abc1k1 abc1k3双突变体则可恢复类囊体膜PQ库稳态并维持光合作用稳态。因此,ABC1K1位于ABC1K3上游,通过抑制ABC1K3的功能解除其对PQ转运的抑制,进而调控质体小球向类囊体的PQ供应,该过程是叶绿体红光光合适应的关键环节。
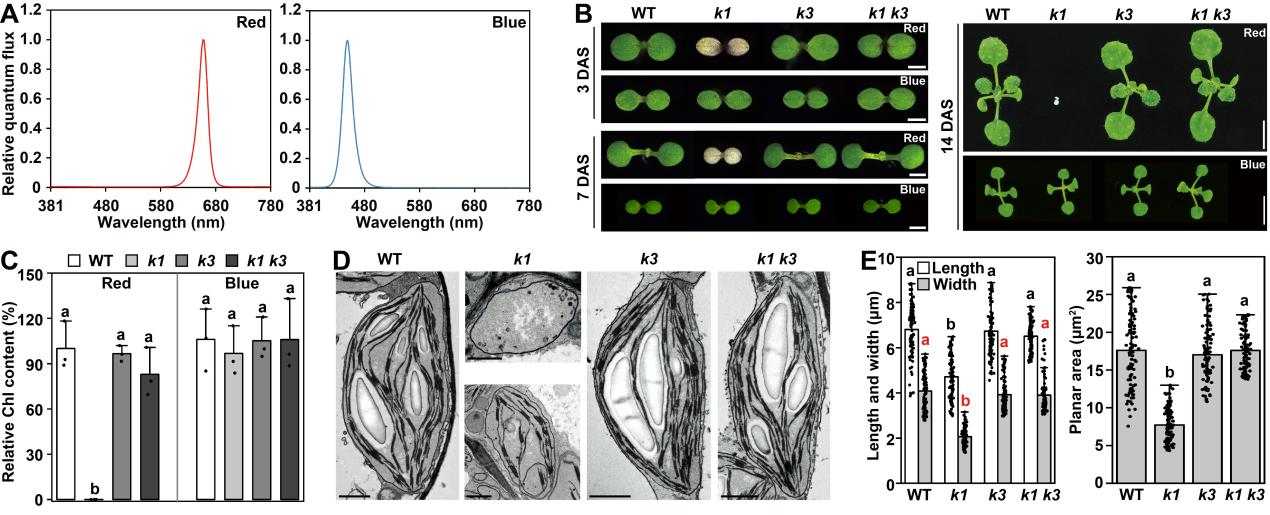
图1 ABC1K1和ABC1K3拮抗调控叶绿体红光适应性
研究人员发现类囊体PQ库信号是调控ABC1K1–ABC1K3激酶复合体的“开关”。红光优先激发PSⅡ导致类囊体PQ库过度还原,并进一步激活类囊体膜定位的氧化还原酶LTO1(LUMEN THIOL OXIDOREDUCTASE 1)。激活的LTO1催化ABC1K1的Cys107形成分子间二硫键,驱动ABC1K1从二聚体组装为高分子量寡聚体。ABC1K1寡聚体通过增强与ABC1K3寡聚体的相互作用,解除ABC1K3对PQ从质体小球向类囊体转运的抑制;最终PQ转运效率提升使类囊体PQ库稳态恢复,既保障光合电子传递的高效性,又增强叶绿体对¹O₂的清除能力,有效抑制PSⅡ光损伤的发生。若Cys107突变为Ala,ABC1K1C107A寡聚化能力降低,从而无法解除ABC1K3对PQ从质体小球向类囊体转运的抑制。该研究首次揭示了质体小球通过“氧化还原调控的激酶复合体”整合环境光信号与叶绿体光合稳态的分子机制,填补了质体小球信号转导研究的空白,证明质体小球不仅是“代谢库”,更是“信号转导枢纽”。同时,该研究为通过基因工程优化作物光合效率提供了新靶点,如增强ABC1K1的寡聚化能力或抑制ABC1K3活性,可能提升作物在高红光环境中(如设施农业)的光合适应性,未来或助力设施作物增产。
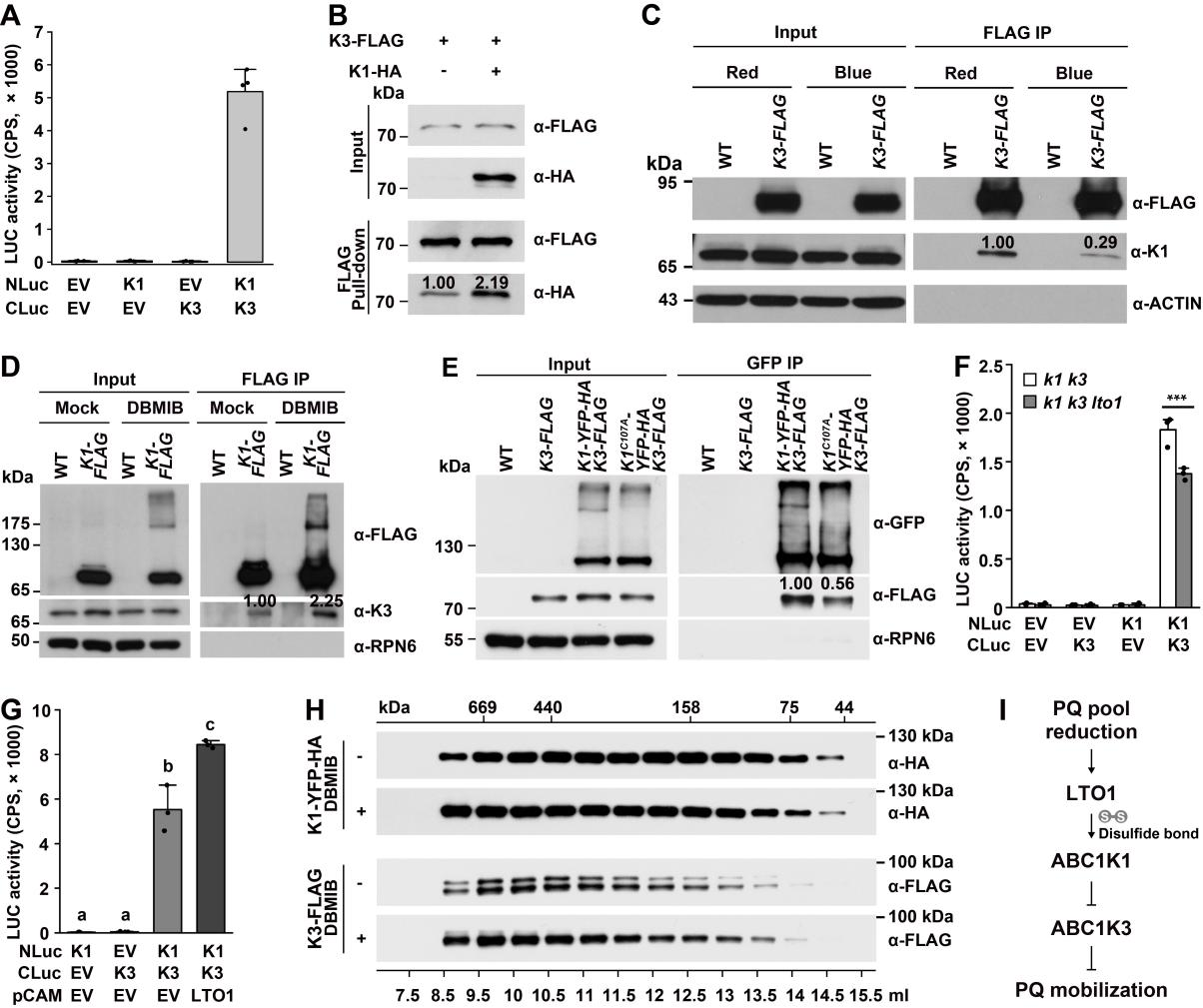
图2 ABC1K1抑制ABC1K3功能的作用机制
北京大学现代农业研究院邓兴旺院士为该论文的通讯作者。北京大学现代农业研究院副研究员杨玫为该论文第一作者。北京大学-清华大学生命科学联合中心黄浩博士,北京大学现代农学院徐超博士和研究生常乐,北京大学现代农业研究院韩雪博士、秦国臣博士和何航博士,以及北京大学生命科学学院林芳博士(现就职于兰州大学生命科学学院)和王训成博士(现就职于北京市农林科学院植物保护研究所)对研究做出了重要贡献。该研究得到了国家自然科学基金重点项目、山东省技术创新项目、山东省自然科学基金及北京大学现代农业研究院基金等资助,并得到了北京大学现代农业研究院,潍坊现代农业山东省实验室和北大-清华生命联合中心的支持。
原文链接:
https://www.cell.com/molecular-plant/abstract/S1674-2052(25)00352-1